夏季川山茶根际土壤细菌群落多样性研究
四川山茶又称为川山茶(CamelliajaponicaL.),作为我国五大山茶花品系之一,因其主要分布在四川地区而得名[1,2]。由于该地区常年湿润多雨,相对空气湿度大,全日照天数少,使得川山茶树姿挺拔秀丽,叶片终年长青,严冬顶霜怒放,在中国茶花中独具一格,具有很高的观赏价值和生态价值。目前,国内规模较大的川山茶搜集、生产和园林应用地点中,以重庆南山植物园山茶园收集、展示川山茶品种类型最为齐全,并于2016年入选首批国家花卉种质资源库;龙茶花海种植茶花5000多亩,被国际茶花协会主席格利高里·戴维斯赞誉为“世界最大的茶花基地”;重庆永川区以茶竹为文化特色,在园林绿化中大量应用川山茶,是重庆市川山茶应用数量较多、效果较好的区县[3]。
根际土壤微生物不仅是土壤有机基质的重要组成部分,其生理活动还对植物养分吸收、土壤性状及植物生长具有明显的影响,并与植物的健康状况有关[4]。通过改善根际微生物的生长环境或者直接施用微生物肥来促进植物生长,已被广泛应用[5]。随着宏基因组概念的提出以及测序技术的快速发展,高通量测序技术已经成为研究土壤微生物多样性和群落结构特征的重要工具[6]。目前,川山茶在繁殖过程中多以扦插和嫁接为主,嫁接的砧木多以油茶为主。国内对油茶和茶树根际微生物的研究已经比较成熟[4,5,7],但是这些研究多集中于自然环境下,如林地、林场等,对于城市绿地内山茶的根际微生物研究,却鲜有报道。
为了推进川山茶在重庆市园林绿化中的运用,本项目在高温干旱条件下,测定四个地点内土壤质量和川山茶根际细菌的种类及丰度,分析影响川山茶生长的优势菌种,及其与土壤环境之间的相关关系。本项目的研究成果以期为川山茶市街应用的科学栽培和管护技术提供理论支撑,以解决川山茶在我市园林绿化中运用的技术瓶颈。
1/试验材料及方法
1.1试验材料
2020年8月,在连续5日未降雨的三伏天期间,对南山植物园、龙茶花海、九曲河湿地公园和永川城区进行川山茶根际土壤取样。其中南山植物园、龙茶花海和九曲河湿地公园每个地点取样3个;永川城区的采样地点分别为兴龙大道、红河大道、学府大道、人民西路、望贤公园、兴龙湖公园、灵猴广场和人民广场,共计8个样品。以南山植物园和龙茶花海为对照。
1.2试验方法
1.2.1土壤质量测定方法
采用混合采样法,在距树干30cm处采取0-30cm深的土壤样品共计7个,送至重庆市土壤质量检测中心,测定pH、EC值、有机质含量、有效氮、有效磷、速效钾、>2mm砾石含量和土壤质地等8项指标。
1.2.2DNA抽提和PCR扩增
根据E.Z.N.A.®soilDNAkit(OmegaBio-tek,Norcross,GA,U.S.)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16SrRNA基因V3-V4可变区进行PCR扩增,扩增程序如下:95℃预变性3min,27个循环(95℃变性30s,55℃退火30s,72℃延伸30s),然后72℃稳定延伸10min,最后在4℃进行保存(PCR仪:ABIGeneAmp®9700型)。PCR反应体系为:5×TransStartFastPfu缓冲液4μL,2.5mMdNTPs2μL,上游引物(5uM)0.8μL,下游引物(5uM)0.8μL,TransStartFastPfuDNA聚合酶0.4μL,模板DNA10ng,补足至20μL。每个样本3个重复。
1.2.3IlluminaMiseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrepDNAGelExtractionKit(AxygenBiosciences,UnionCity,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTflexTMRapidDNA-SeqKit(BiooScientific,美国)进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的MiseqPE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBISRA数据库(序列号:SRP***)。
1.2.4根际土壤采样方法
距离主根0.3m处开始挖土壤剖面,从细根(≤2mm)开始出现的位置,抖动细根后将黏附在根段上的土壤视为根际土壤,取样约1g。将采集的土壤放置于5mL离心管,密封保存于干冰箱中,送至上海美吉生物医药科技有限公司用于根际微生物群落测定。
1.3数据处理
使用fastp软件[8](https://github.com/OpenGene/fastp,version0.20.0)对原始测序序列进行质控,使用FLASH软件[9](http://www.cbcb.umd.edu/software/flash,version1.2.7)进行拼接:
(1)过滤reads尾部质量值20以下的碱基,设置50bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50bp以下的reads,去除含N碱基的reads;
(2)根据PEreads之间的overlap关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10bp;
(3)拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;
(4)根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
基于默认参数,使用Qiime2流程[10]中的DADA2[11]插件对质控拼接之后的优化序列进行降噪处理。DADA2降噪处理之后的序列通常被称为ASVs(即扩增子序列变体)。为了降低测序深度对后续Alpha多样性和Beta多样性等分析结果的影响,将每个样本降噪后的序列数抽平到4000条,抽平后每个样本的平均覆盖度(Good’scoverage)依然能达到97.90%。基于Sliva16SrRNA数据库(v138),使用Qiime2中的Naivebayes(或Vsearch、或Blast)分类器对ASVs进行物种分类学分析。通过上海美吉生物医药科技有限公司的多样性云分析平台(Qiime2流程)(cloud.majorbio.com)进行供后续的数据分析。
2/结果与分析
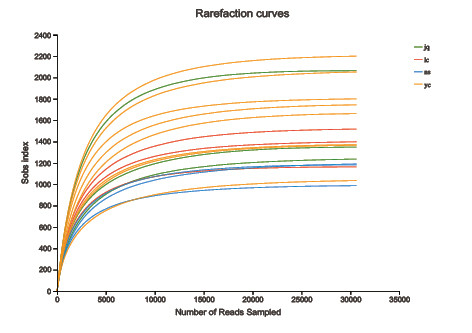
2.1土壤样品测序结果与测序深度评估
通过对不同地点川山茶根际土壤的16SrDNA测序,基于IlluminaMiseqPE300测序平台测序共得到17640条有效数据序列,以最小样本序列数对序列进行抽平,共得到17596个ASV,由图1所示,土壤样品的稀释曲线皆趋于平缓,说明该测序深度已基本覆盖样品中所有细菌类群,能够反应不同地点川山茶根际土壤细菌群落的真实情况。
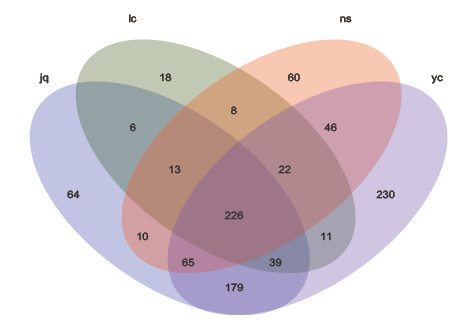
由图2所示,四个地点川山茶根际土壤样品中细菌属的数量变化较大,分别为南山植物园450个、龙茶花海343个、九曲河湿地公园602个、永川城区818个。其中四个地点共有226个属,各地独有属的数量从大到小排序为:永川城区(230)>九曲河湿地公园(64)>南山植物园(60)>龙茶花海(18)。南山植物园和龙茶花海栽植的川山茶生长受人为活动干扰较少,其细菌属的数量较九曲河湿地公园和永川城区少,两地共有269个属,分别占各自属数量的59.78%和78.43%;受人为互动干扰较大的九曲河湿地公园和永川城区的根际土壤中,细菌属的数量较多,两地共有509个属,分别占各自属数量的84.55%和62.22%。
2.2四个地点川山茶根际土壤细菌群落α多样性
| 序号 | 地点 | Sobs 指数 | Shannon 指数 | Shannoneven 指数 | Coverage 指数 | PD指数 |
| 1 | 南山植物园(ns) | 1121±115a | 5.986±0.197a | 0.853±0.023a | 0.9991±0.0008a | 97.89±11.95a |
| 2 | 龙茶花海(lc) | 1360±180a | 6.410±0.203a | 0.889±0.011a | 0.9990±0.0006a | 108.80±10.71a |
| 3 | 九曲河湿地公园jq) | 1550±449a | 6.483±0.636a | 0.884±0.053a | 0.9994±0.0008a | 140.50±33.61a |
| 4 | 永川城区(yc) | 1655±384a | 6.635±0.510a | 0.897±0.041a | 09987±0.0004a | 140.10±27.72a |
| 5 | Sig. | 0.307 | 0.366 | 0.507 | 0.507 | 0.307 |
α多样性指数的统计结果见表1,四个地点川山茶根际细菌的Coverage指数都接近100%,由此也进一步证明样本序列被检测出的完整性,在此水平上的测序结果能够反映出所测样本中细菌群落组成的真实情况。本试验采用香农指数(Shannon)反映细菌群落多样性,Sobs指数反映细菌群落丰富度,Shannoneven指数反映细菌群落均匀度,PD指数反映细菌群落谱系多样性。由表1可见,九曲河湿地公园和永川城区川山茶根际土壤样品具有较高的Sobs指数、Shannon指数、Shannoneven指数和PD指数,说明该地点川山茶根际细菌群落多样性、丰富度、均匀度和谱系多样性较高,但是四个地点之间川山茶根际土壤中细菌多样性、丰富度、均匀度和谱系多样性未达到显著差异。
小写字母不同则差异显著,反之亦然;大写字母不同则差异极显著,反之亦然。
2.3根际细菌群落组成
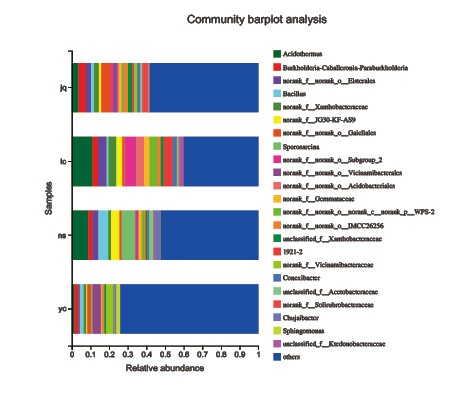
土壤样品的ASV代表序列经过对比鉴定共得到42门、141纲、327目、510科、997属和2280种的土壤细菌物种信息。在属水平上,如图3所示,川山茶根际土壤中主要的优势细菌属为热酸菌属(Acidothermus)、Burkholderia-Caballeronia-Paraburkholderia、norank_f_norank_o_Elsterales、Bacillus,这4类菌群在不同地点川山茶根际土壤中的比例存在一定差异。其中热酸菌属在四个地点川山茶根际土壤中的丰度变化最大,在人为干扰较小的龙茶花海和南山植物园占比最高,达到11.15%和8.86%;在人为干扰较大的九曲河湿地公园和永川城区,占比降至3.47%和1.49%。龙茶花海川山茶根际土壤中热酸菌属的丰度约为永川城区的10倍。
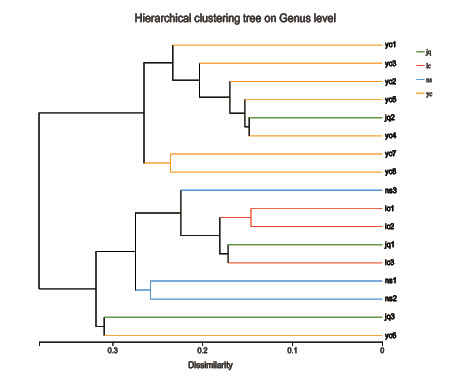
对土壤样品中细菌群落进行UPGMA聚类分析(图4),分析比较具有显著差异的微生物群落。结果显示不同地点川山茶根际土壤中细菌群落组成可以分为两大类,龙茶花海和南山植物园中川山茶根际土壤的细菌群落组成具有很高的相似性,并与九曲河湿地公园的样点1和样点3及永川兴龙湖公园归为一类;永川城区兴龙大道、红河大道、学府大道、人民西路、望贤公园、灵猴广场和人民广场与九曲河湿地公园样点2中川山茶根际土壤的细菌群落组成具有很高的相似性,归为第二类。
据微生物特色学科信息门户网站介绍,热酸菌嗜高温,生长范围是37~70℃。嗜酸,可在pH3.5~7.0生长。结合聚类分析结果发现,兴龙湖公园、九曲河湿地公园的样点1和样点3的pH值均小于7.0,故归为一类。热酸菌嗜高温的特性可能与川山茶的耐热性有关。
2.4根际细菌群落与环境因子的相关性
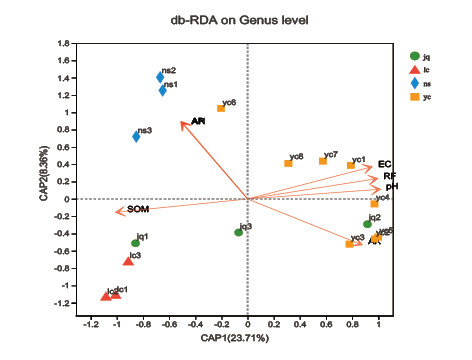
采用db-RDA分析探究影响四个地点川山茶根际土壤细菌群落组成的环境因子(图5),包括土壤的pH、EC值、有机质、速效氮、速效磷、速效钾和>2mm砾石含量。由图3-24所示,其中第一排序轴的解释量为23.71%,第二排序轴的解释量为8.36%。pH、有机质、速效氮、速效磷、速效钾和>2mm砾石含量为显著影响川山茶根际细菌群落组成的环境因子(Sig.<0.05),其中,>2mm砾石含量和速效氮与物种组成呈显著相关关系(Sig.<0.05),pH、土壤有机质、速效磷和速效钾与物种组成呈极显著相关关系(Sig.<0.05)。
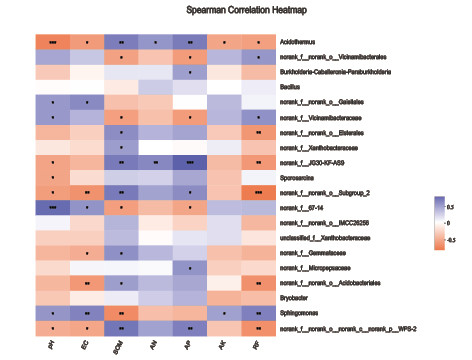
同时利用Spearman相关性分析,选取属水平前20的物种进行土壤理化因子与其相对含量之间的相关分析,相关性热点图由图6所示。结果表明速效氮与属水平上物种分布具有显著的正相关关系(Sig.<0.05),pH值与热酸菌属呈极显著负相关,与norank_f_67-14呈极显著负相关(Sig.<0.05)。热酸菌属与所有土壤指标有显著相关关系。
3/结论与讨论
以四个地点川山茶根际土壤为研究对象,利用高通量测序技术对川山茶根际土壤细菌进行测序,分析了细菌群落与环境因子的关系,以探究影响细菌群落的关键环境因子,得出以下主要结论:
(1)土壤样品的ASV代表序列经过对比鉴定共得到42门、141纲、327目、510科、997属和2280种的土壤细菌物种信息。在属水平上,川山茶根际土壤中主要的优势细菌属为热酸菌属(Acidothermus)、Burkholderia-Caballeronia-Paraburkholderia、norank_f_norank_o_Elsterales、Bacillus,这4类菌群在不同地点川山茶根际土壤中的比例存在一定差异。其中热酸菌属在四个地点川山茶根际土壤中的丰度变化最大,以龙茶花海和南山植物园占比最高,达到11.15%和8.86%。该结果与传统方式栽植茶园中的结果相似[12]。九曲河湿地公园和永川城区占比降至3.47%和1.49%。龙茶花海川山茶根际土壤中热酸菌属的丰度约为永川城区的10倍。
(2)通过UPGMA聚类分析发现,不同地点川山茶根际土壤中细菌群落组成可以分为两大类,龙茶花海和南山植物园中川山茶根际土壤的细菌群落组成具有很高的相似性,并与九曲河湿地公园的样点1和样点3及永川兴龙湖公园归为一类;永川城区兴龙大道、红河大道、学府大道、人民西路、望贤公园、灵猴广场、人民广场与九曲河湿地公园样点2中川山茶根际土壤的细菌群落组成具有很高的相似性,归为第二类。龙茶花海和南山植物园作为川山茶的生产基地和种质保存地,川山茶长势较好[3],由此可见第一类为川山茶长势较好的,第二类为长势一般的。
(3)通过环境因子与根际细菌群落关系的研究表明,pH、有机质、速效氮、速效磷、速效钾和>2mm砾石含量为显著影响川山茶根际细菌群落组成的环境因子(Sig.<0.05)。热酸菌属与所有土壤指标有显著相关关系。
综上所述,在夏季高温干旱条件下,川山茶根际土壤中热酸菌属的丰度与植株的生长势相关。市街绿化土壤中出现碱化、有机质含量低等问题,川山茶喜酸性、有机质含量高的土壤[2],热酸菌喜酸性且营养富集的环境[12]。因此川山茶在市街应用时,应采取以土壤调酸和提高有机质含量为主的改土措施。这不仅有助于促进川山茶须根的生长,还有助于提高川山茶根际土壤中热酸菌属的丰度,从而进一步促进营养物质的吸收[4,5]。
参考文献:
[1]周利.川茶花品种图鉴[M].重庆:重庆出版社,2011.
[2]LY/T2814—2017,川山茶栽培技术规程[S].
[3]邹世慧,李玲莉,田中,等.基于TRU系统对三种不同立地条件下川山茶根系空间分布的研究[J].湖北农业科学,2021,60(15):101-106.
[4]桑淼.油茶根际土壤微生物研究[D].福建农林大学,2013.2020,47(4):604-609.
[5]韩文炎,阮建云,林智,等.茶园土壤主要营养障碍因子及系列茶树专用肥的研制[J].茶叶科学,2002,22(1):70-74.
[6]李媛媛,彭梦文,党寒利,等.塔里木河下游胡杨根际土壤细菌群落多样性分析[J].干旱区地理,2011.(网络首发)
[7]邹振浩,颜鹏,李鑫,等.茶园土壤微生物氮含量及其影响因子的研究[J].茶叶通讯,2020,47(4):604-609.
[8]ChenShifu,ZhouYanqing,ChenYaru,etal.fastp:anultra-fastall-in-oneFASTQpreprocessor[J].Bioinformatics,2018,34(17):884-890.
[9]MagocTanja,SalzbergSL.FLASH:fastlengthadjustmentofshortreadstoimprovegenomeassemblies[J].Bioinformatics,(21):21.
[10]BolyenE,RideoutJR,DillonMR,etal.Reproducible,interactive,scalableandextensiblemicrobiomedatascienceusingQIIME2[J].2019,NatureBiotechnology37:852-857.
[11]CallahanBJ,McmurdiePJ,RosenMJ,etal.DADA2:High-resolutionsampleinferencefromIlluminaamplicondata[J].NatureMethods,2016,13(7):581-583.
[12]LinGY,ChenBJ,HuCYetal.Theimpactsoffieldmanagementonsoilandtearootmicrobiomes[J].AppliedMicrobiology,2021,1:361-376.
版权归原作者所有。如认为内容侵权,请联系我们删除。
- 主办:重庆市风景园林学会承办:重庆立意园林咨询有限公司
- 学会电话:(023)68801472 63673736 63673738 63892447QQ:944865067
- 地址:重庆菜袁路205号世纪花城A栋3楼
- 渝ICP备11002947号-1 渝公网安备 50010302002828号


